1Magyar Honvédség Egészségügyi Központ, Gasztroenterológiai Osztály, Budapest
Speciális szempontok a gyulladásos bélbetegek gondozása során a guideline-ok ismeretében
A colitis ulcerosa és a Crohn-betegség (közösen: gyulladásos bélbetegség [Inflammatory bowel disease, IBD]) sajnos még mindig ismeretlen eredetű krónikus gyulladásos bélbetegségnek számít, oki kezelése még nincs, ezért meggyógyítani nem tudjuk. A legtöbb esetben azonban a rendelkezésre álló gyógyszerekkel elérhető a betegség remissziója, csökkenthető a relapszusok gyakorisága, a szövődmények előfordulása, sőt a tartós kezelésnek a kolorektális karcinóma szempontjából kemopreventív hatása is van. Mindehhez szükségünk van a beteg együttműködésére, az infekciós és a daganatos szövődmények megelőzésére. A betegek társaikhoz hasonló életminőségének elérésének elengedhetetlen része a leggyakoribb szövődmények, pl. anémia értékelése és kezelése, valamint a megfelelő tápláltság eléréséhez a megfelelő diéta alkalmazása. Ezekben a témákban szeretnék útmutatót adni néhány gondolat erejéig a legfrissebb ajánlások ismeretében.
Beteg-compliance és -adherencia IBD-ben
A nem megfelelő gyógyszerszedés IBD-ben gyakori, az IBD-ben szenvedő betegek kb. harmada, legalábbis betegsége egyes szakaszaiban, nem adherens. Könnyebben kezelhetők azok a betegek, akik éppen rossz állapotban vannak. A panaszmentes betegek hajlamosabbak a kezelés visszautasítására vagy önkényes elhagyására. Nem mindegy az sem, hogy milyen gyógyszeres kezelésre van szükség. IBD-kezelésére a sulfasalazin, a mesalazin, lokális és szisztémás szteroid, azathioprin, metothrexat, infliximab, adalimumab és a vedolizumab a legtöbbször használt készítmény. A betegek többsége fél az immunszuppresszív szerektől, ezeket fogadja el a legnehezebben. Egy interaktív felmérés szerint számos oka lehet a non-compliance-nek, a legfontosabbakat az 1. táblázat mutatja be (1. táblázat).
Gyógyszerfüggő tényezők megfelelő orvos-beteg kapcsolat, megfelelő gyógyszerrezsim kiválasztása révén kiküszöbölhetők. Gyulladásos bélbetegek kezelése során leggyakrabban alkalmazott hatóanyag a mesalazin, amely a Crohn-betegség kezelésében kevésbé játszik szerepet, de colitis ulcerosa kezelésében elsővonalbeli kezelésnek számít. Irodalmi adatok szerint az 5-ASA elhagyása (non-compliance) a betegek 60 százalékánál megfigyelhető – mindezzel együtt kb. ötszörösére emelkedik a relapszusok előfordulása, ezáltal nőnek a kórházi költségek és romlik a betegek életminősége.
Teendők
A krónikus kezelés egyeztetése, megbeszélése rendkívül fontos. Törekedni kell a legkevesebb fajta és az egyszerűen alkalmazható, még hatásos gyógyszer beállítására. Javítja az adherenciát, ha olyan gyógyszerkiszerelést alkalmazunk, hogy a beteg a napi adagot egyszerre vehesse be. 2017-es ECCO guideline ajánlása szerint napi egyszeri adagolás ugyanolyan hatékony, mint az osztott bevitel. Ismerni kell a beteg pszichéjét, életkörülményeit, munkáját, életmódját. Aktív dolgozótól nem várható el, hogy munkaidő alatt mindig bevegye a gyógyszerét, hogy munkába induláskor rektális gyógyszert alkalmazzon. Közösen kell tehát meghatározni, hogy a beteg milyen utasításokat tud betartani. Ugyanakkor nyomatékosan fel kell hívni a figyelmet a fenntartó kezelés fontosságára, a kezelés elmaradásának kockázatára, de az esetleges mellékhatásokra is, tehát a non-adherencia lehetséges következményeire. Általános emberi tulajdonság, hogy ellenőrzés nélkül mindenki hajlamos elfeledkezni a bajról, ezért is fontos a tartósan panaszmentes beteg rendszeres ellenőrzése. Ilyenkor a szükséges kontrollvizsgálatokon kívül megerősítjük a beteg motivációját; kiderül, hogy rendszeresen szedi-e a megbeszélt gyógyszert; van-e egyáltalán gyógyszere; tájékozódunk életviteléről és támogatjuk a normális életvitel folytatásában.
IBD és malignitás
A daganatos betegségek gyakoribb előfordulásával kell számolnunk az átlagéletkor növekedésével. Gyulladásos bélbetegek esetén fokozott rizikóval kell számolnunk a kolorektális rákok és az epeúti rákok előfordulása terén mind a krónikus gyulladás fennállása, mind az IBD kezelése során alkalmazott immunszuppresszáns kezelés mellékhatásaként. Colitis ulcerosa esetén a betegség kiterjedése, betegség fennállásának ideje, a családi anamnézisben szereplő kolorektális rák és a társuló primer szklerotizáló kolangitisz (PSC) jelentik a legfőbb rizikótényezőt. Általánosságban azt mondhatjuk az IBD-s, kolorektális daganatos betegek fiatalabbak a nem IBD-s kolorektális daganatos betegeknél. A legnagyobb rizikótényezőt
a diszplázia (főleg a súlyos diszplázia) jelenti, ezért nem győzzük hangsúlyozni a rendszeres endoszkópos-szövettani ellenőrzések szerepét. Totál colectomia, ileoanális pouch anasztomózis (IPAA) esetén vastagbélrák
kialakulásának rizikóját a műtét előtti diszplázia vagy a vastagbélben megjelent tumor jelenti. Egyidejűleg fennálló PSC esetén fokozott cholangiocarcinoma-veszéllyel kell számolnunk.
Crohn-betegségben a perianális vagy enterokután fisztulák talaján kialakuló malignus elfajulás ritka, azonban fiatal nőbetegekben fokozott figyelmet kell fordítanunk a perianális fisztulák malignizálódásának a veszélyére. Krónikusan aktív perianális érintettség esetén megjelenő új tünetet, pl. új keletű fájdalom esetén mindig fokozott figyelmet kell fordítanunk e régió megvizsgálására is. Vékonybél-érintettségű Crohn-betegségben fokozott a vékonybélrák kialakulásának a rizikója. Elsősorban a gyulladt bélszakaszokon lehet számítani a kialakulására, leggyakoribb szövettani típus az adenokarcinóma. Tartósan fennálló szűkület is rizikótényezőt jelent vékonybélrák kialakulása szempontjából.
Gyulladásos bélbetegekben előforduló extraintesztinális daganatok előfordulásának rizikója nem gyakoribb, mint az átlagpopulációban. Ennek ellenére az egyes tumorregiszterek arról számolnak be, hogy Crohn-betegekben gyakoribb a felső gasztrointesztinális traktus, a tüdő, a húgyhólyag, valamint a non-melanoma bőrrák előfordulása. Squamosus és bazálsejtes karcinóma előfordulása a leggyakoribb a bőrrákok között, előfordulásuk elsősorban az időskorra jellemző. Immunszupprimált betegek esetén mindenképpen javasolt a tartós napsugárzás kerülése, illetve a megfelelő fényvédő faktorok alkalmazása. Colitis ulcerosás betegek esetén gyakoribb a leukémia, a limfóma, elsősorban a non-Hodgkin-limfóma előfordulása. Elsősorban a korai betegségmegjelenés, a férfinem, a 65 év feletti életkor jelentik a hematológiai rosszindulatú betegségek rizikótényezőit. Kezelésre nem javuló vérképeltérések, aktivitással nem magyarázható lázas állapot, nyirokcsomó-megnagyobbodás, hepatoszplenomegália esetén hematológiai kórképet mindig ki kell zárni.
Daganatos betegségek – IBD-terápia kapcsolata: az immunszuppresszív szerek veszélyei
A thiopurinkezelés fokozott limfómakockázatot jelent, elsősorban férfi betegekben, irodalmi adatok alapján két életkorbeli csúcs figyelhető meg: 30 év alatti, illetve 50 év feletti férfiakban volt gyakoribb a limfóma előfordulása. Emellett thiopurinkezelés mellett fokozott az akut mieloid leukémia és a mioleodiszpláziás szindrómák előfordulása. Alapbetegséggel összefüggésbe nem hozható láz, megnagyobbodott nyirokcsomók, hepatosplenomegalia esetén minden esetben gondolni kell vérképzőszervi eltérés megjelenésére is, hematológiai konzultáció elvégzése javasolt. EBV szeronegativitás esetén ezen tünetek megjelenésekor, egyidejű thioprurin kezelés esetén minden esetben merüljön fel bennünk postmononucleosisos lymphoma lehetősége.
Anti-TNF-kezelés mellett 1,32-szer gyakoribbnak találtak a bőrmelanoma előfordulását, függetlenül a kombinált thiopurinkezeléstől. Azathioprin-, illetve anti-TNF-kezelés alatt álló betegek fokozott fényvédelmére figyelmet kell fordítani, emellett fontos felhívni a figyelmüket a rendszeres bőrgyógyászati szűrésre.
A gyulladásos bélbetegségek kezelése során alkalmazott immunszuppresszánsok (szte-
roidok, methotrexat, azathioprin, biológiai szerek) tartós alkalmazásának a daganatos betegségek előfordulásához képest lénye-
gesen gyakoribb, mindennapokban előforduló velejárója, hogy a betegek fokozott fer-tőzésveszélynek vannak kitéve. Hangsúlyoznunk kell, hogy az immunszupprimált be-tegekben a fertőzések gyakrabban és súlyosabb formában jelentkeznek, gyakran hospitalizációt igényelnek, akár életveszélyesek is lehetnek.
A fertőzések jelentős hányada megelőzhető időben és szakszerűen végzett védőoltásokkal (2. táblázat).
Védőoltások alkalmazása felnőttkori gyulladásos bélbetegségek esetén
A fertőzésekre hajlamosító kezelések közé
a huzamosan (több mint két hétig, legalább napi 20 mg prednisolonekvivalens dózisban alkalmazott kortikoszteroidkészítménye)
az adekvát adagolású immunszuppresszáns szerek (pl. azathioprin, methotrexat, ciclosporin stb.) és a biológiai készítmények tartoznak. A fertőzések rizikótényezőjeként említhetjük még az életkort, a súlyos társ-
betegségek jelenlétét, valamint az alapbetegség szövődményeként kialakuló alultápláltságot.
A beteg immunizálása már a diagnózis felállításakor javasolt, mivel a kórkép gyakran progresszív lefolyású, és előbb-utóbb nagy valószínűséggel immunszuppresszáns kezelésre szorul a beteg. Az immunszuppresszáns kezelések bevezetésével, főszabályként az élő attenuált oltóanyagok adása kontraindikálttá válik. A beteg környezete, illetve az aktuális járványhelyzet okozta veszély kivédése érdekében a közvetlen környezet (pl. a család vagy a beteget gondozó, kezelő személyzet) oltása is szükségessé válhat a beteg védelme érdekében (fészekimmunizáció).
Anémia gyulladásos bélbetegben
Normál hematokrit- (HTK-) érték a vérben nők esetén >37%, férfiak esetén >40%, hemoglobin- (Hgb-) érték pedig nőkben >120 g/l, férfiakban >130 g/l. Ez alatti értékek esetén vérszegénységről beszélünk.
Vashiányos vérszegénység
Az Európai Crohn-Colitis Társaság (ECCO) ajánlása szerint remisszió vagy enyhe aktivitás esetén 6-12 havonta, aktív betegség esetén pedig 3 havonta szükséges vérvétel a vérképzés általános felmérésére (vérkép, szérumvas, ferritin). Kiterjedt vékonybél- vagy terminálisileum-reszekción átesett betegeknél macrocytosis esetén legkésőbb évente mérni kell a folsav és a B12-vitamin szérumszintjét. A gyulladás és a vasanyagcsere szoros kapcsolatban áll egymással, így a CRP mérése nemcsak a betegség aktivitása, hanem a vasanyagcsere monitorozása szempontjából is meghatározó. A szervezet napi vasszükséglete férfiak esetén 1 mg, menstruáló nők esetén 2 mg, terhességben 3 mg. A táplálékkal bevitt vas kb. 10%-a szívódik fel, amely szükség esetén 20%-ra emelkedhet.
Gyulladásos bélbetegekre a felszívódási zavar, a vérzés következtében fokozott vérvesztés és a krónikus gyulladás okozta vasanyagcsere-zavar jellemző. A vashiányt a vasraktárak felmérésével, a ferritinszint meghatározásával érdemes kezdeni. Remisszió esetén 30 mcg/l alatti szérumferritin-szint vashiányt mutat.
Az ECCO ajánlása alapján vashiányos vérszegénység esetén vaspótlás szükséges minden gyulladásos bélbetegben. Cél a vérszegénység korrekciója és a vasraktárak feltöltése, ami általában több hónapot vesz igénybe. Aktív betegségben, korábbi orális vaskezelés során kialakult jelentős mellékhatások, súlyos vérszegénység (<100 g/l) és erythropoetinkezelés esetén vénás vaspótlást kell alkalmazni.
Orális vaspótlás enyhe vérszegénység (110-119 g/l nem terhes nőkben, 110-129 g/l férfiakban), klinikailag inaktív betegek esetén alkalmazható, kivéve, ha a betegnél korábbi orális vaspótlás mellékhatásokat okozott (8). Az orális vaspótlás során kialakuló mellékhatások dózisfüggőek, és főleg ferroszulfátkészítményekkel történt kezelés alkalmával jelentkeztek. Az újabb készítmények mellékhatásprofilja jobbnak bizonyult.
Nem vashiányos vérszegénység
Annak függvényében, hogy milyen a gyakoriságuk, gyulladásos bélbetegekben a nem vashiányos vérszegénységet három csoportra osztjuk (8). Gyulladásos bélbetegségben gyakran fordul elő kónikus betegséghez társult vérszegénység, alkalomszerűen B12-vitamin-, folsavhiány és gyógyszer indukálta vérszegénység, ritkán hemolízis, mielodiszplázia, aplasticus anaemia, glükóz-6-foszfát dehidrogenáz defektus.
A B12-vitamin és a folsavhiány kezelése
Makrociter vérképzés (MCV >100 fL) esetén meg kell mérni a beteg folsav- és B12-vitamin-szintjét. Kombinált vas-, B12-vitamin- és folsavhiány esetén az MCV normális is lehet. Normális szérumfolsav-szint 4 ng/l feletti érték, folsavhiányról 2 ng/l alatt beszélünk. Általában elfogadható, hogy 300 pg/ml felett normális a B12-vitamin-ellátottság, 200 pg/ml alatt pedig B12-vitamin-hiány áll fenn. Folsavhiány esetén csak a vérszegénységhez társuló klinikai tünetek jelentkeznek, de B12-vitamin-hiányban ez idegrendszeri problémákkal is társul. A neurológiai tünetek közül korán megjelenik a járásbizonytalanság, a mély- és a vibrációérzés zavara. Súlyos esetben parézist is okozhat. A vérszegénységet – még felszívódási zavar esetén is – napi 1-5 mg folsav orális pótlásával normalizálhatjuk. A kezelést addig folytatjuk, amíg hematológiai zavar teljes mértékben helyreáll, ez általában 1-4 hónapot vesz igénybe. Fontos, hogy a kezelés megkezdése előtt felmérjük a B12-vitamin-ellátottságot, ugyanis hiányában a neurológiai tünetek fokozódhatnak. A B12-vitamin-pótlásra leginkább a parenterális, izomba adható készítmények terjedtek el. Először 1 hétig napi 1000 mcg-ot, majd ezt a mennyiséget hetente négy hétig kell alkalmazni. Ha a hiányt kialakító betegség nem szüntethető meg (pl. terminálisileum-reszekció), akkor havonta 1000 mcg fenntartó kezelés szükséges a beteg élete végéig. Betegenként alkalmazhatunk ettől eltérő, személyre szabott adagolási módot, amit a beteg szérumszintjeihez igazítunk, bár a B12-vitamin vizelettel gyorsan kiürül, túladagolás nem valószínű, következményei elhanyagolhatóak. Alacsonyabb dózis esetén viszont a hatás is később alakul ki. A szájon át bevihető szintetikus B12-vitamin szabad formában könnyen felszívódik. Néhány randomizált klinikai vizsgálatban a nagy dózisú (1000-2000 mcg/nap) orális B12-vitamin adása ugyanolyan hatékonynak bizonyult, mint az izomba adható forma.
A thiopurin- és a 6-mercaptopirin-kezelés következménye a makrociter vérképzés. A thiopurinkezelés bevezetése (célérték: 2-2,5 mg/ tskg) rendszeres vérképellenőrzés mellett történik, mivel a kezelés során súlyos pancitopénia is kialakulhat. Thiopurinkezelés mellett 3 havonta ezért vérképellenőrzés szükséges. Thiopurinkezelés során pancitopénia mellett autoimmun hemolitikus anémia, leukopénia, trombocitopénia, makrocitózis és tiszta vörösvérsejt-aplázia is előfordulhat. Ha a vérszegénységnek nincs más oka, akkor a dózist lehet módosítani, vagy mérlegelni kell a kezelés leállítását. A thiopurinszármazékok ritkán okoznak izolált vérszegénységet.
Sulfasalazinkezelés mellett (folsavreduktáz gátlása) folsavhiány, makrociter vérszegénység alakulhat ki, amely folsav adásával azonban megelőzhető. Mellékhatásként ritkán hemolízist és apláziát is okozhat.
Gyulladásos bélbetegség – tápláltsági állapot, diéta
Az alultápláltság kialakulása szempontjából az aktív gyulladásos bélbetegség, terápiarezisztens bélbetegség jelenti a legnagyobb rizikót. Alultáplált beteg gyakrabban kerül a sürgősségi osztályon keresztül felvételre, gyakoribbak az infekciós szövődmények, valamint a hospitalizált beteg esetén a malnutríció független rizikótényezője a mélyvénás trombózisnak, sürgősségi műtétnek, hosszabb kórházi tartózkodásnak, és fokozza a mortalitást is. Az IBD-s betegeknek fokozott rizikója van malnutríció kialakulására, ezért már a diagnózis pillanatában, illetve azt követően, rendszeresen szűrni kell a tápláltsági állapotot. Dokumentált malnutríció esetén a betegek táplálásterápiája javasolt, mivel a malnutríció rontja a prognózist, fokozza a szövődmények kockázatát, a mortalitást és rontja az életminőséget.
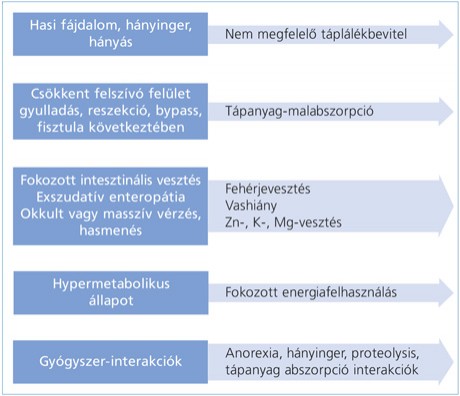
A malnutríció kialakulásának számos tényezője van, az érintett bélszakaszoktól, a klinikai tüneteken keresztül a betegség során alkalmazott gyógyszeres kezelésen át, amelyet az 1. ábrán foglaltam össze (1. ábra).
A diéta kóroki szerepe a gyulladásos bélbetegség kialakulásában
Irodalmi adatok alapján a magas rost- és gyümölcstartalmú étrend a CD kialakulásának kockázatát csökkenti, de a CU-t nem befolyásolja (>22,1 g/nap). Magas gyümölcstartalmú étrend 73-80%-ban csökkentette a CD kialakulásának kockázatát, elsősorban vékonybél-CD esetén. A CU kialakulásának rizikóját fokozza: magas zsírtartalmú étrend, PUFA, omega-6 zsírsavak és húsok, a legjelentősebb tényező a linolénsav. A magas CH-tartalmú étrend és az IBD kialakulása között összefüggés nem igazolódott.
Zöldségekben, gyümölcsökben, n-3-zsírsavakban gazdag, n-6-zsírsavakban szegény diéta csökkenti a Crohn-betegség és colitis ulcerosa kialakulását, ezért ez a diéta általánosságban ajánlható.
A diéta szerepe aktív gyulladásos bélbetegségben
Általánosságban azt mondhatjuk, hogy nincs speciális IBD-diéta, ami ajánlható a remiszszió eléréséhez. Speciális szénhidrátdiéta, paleo étrend, gluténmentes étrend, alacsony FODMAP, PUFA-gazdag étrend szerepe nem bizonyított. Kivételt jelent a strikturával/ sztenózissal járó CD, amennyiben obstrukciós tünetek társulnak hozzá, nagy volumenű jejunosztoma, ileosztoma: ezekben az esetekben figyelembe kell venni azokat az ételintoleranciákat, amelyek a folyadékürítés fokozódásához vezethetnek.
Kizárásos diéták alkalmazása nem javasolt aktív IBD esetén remisszió eléréséhez, kivéve, ha ismert intoleranciák állnak fenn.
– Aktív időszakban alkalmazhatunk kizárólagos enterális táplálást is, felnőttkorban a vizsgálatok eredményei tartós sikerről azonban nem számolnak be, a relapszusráta 1 éven belül: 47-67%:
– az első relapszusig eltelt átlagos idő: 6,5-12,7 hónap,
– rövidtávú hatékonyság testsúly, testösszetétel vonatkozásában.
– Az enterális táplálás előnyös hatásai:
– csökkent antigénterhelés,
– bélnyugalom (elementális diéta),
– trofikus aminosavak biztosítása,
– bélflóra módosítása,
– csökkent bélpermeábilitás.
Crohn-betegek tipikus diétája: rostszegény, gyümölcsökben-zöldségekben szegény, alacsony kalóriatartalmú, számos mikronutriens csökkent bevitelével a betegség aktivitásától függetlenül.
Gyulladásos bélbetegségben remisszió esetén specifikus diéta tartása nem szükséges. (ESPEN guideline).
– Proximális érintettségű Crohn-betegség esetén laktózérzékenység gyakori – ilyenkor laktózmentes étrend tartása javasolt.
– Colitis ulcerosában általános, statisztikailag szignifikáns tendencia: remisszióban maradáshoz kevesebb rostot és zöldséget, több zsírt fogyasztanak a betegek.
– Kohort vizsgálatok eredményei alapján több húst, illetve alkoholt fogyasztóknál magasabb a relapszusráta.
Általánosan javasolható étrend az ún. mediterrán étrend.
2. Harbord M, Eliakim R, Bettenworth D. et al. Third European Evidence-based Consensuson Diagnosis and Management of Ulcerative Colitis. Part 2: Current Management. Journal of Crohn’s and Colitis, 2017; 1–24.
3. Annese V, Beaugerie L, Egan L. et al. Inflammatory Bowel Disease and Malignancies. Journal of Crohn’s and Colitis, 2015; 945–965.
4. Gomollón F, Dignass A, Annese V. et al. 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 1: Diagnosis and Medical Management Journal of Crohn’s and Colitis, 2017; 3–25.
5. Gionchetti P, Dignass A, Danese S. et al. 3rd European Evidence-based Consensus on the Diagnosis and Management of Crohn’s Disease 2016: Part 2: Surgical Management and Special Situations . Journal of Crohn’s and Colitis, 2017; 135–149.
6. Pálinkás D, Szamos T, Kulcsár A. Védőoltások alkalmazása felnőtt gyulladásos bélbetegekben. Háziorvosi Továbbképző Szemle, 2016; 21: 558.
7. Rahier JF, Magro F, Abreu C. et al. Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. Journal of Crohn’s and Colitis, 2014; 443–468.
8. Lőrinczy K, Herszényi L. Vérszegénység és kezelése gyulladásos bélbetegekben. Central European Journal of Gastroenterology and Hepatology. 2016; 2(4): 191–195.
9. Dignass AU, Gasche Ch, Dominik Bettenworth D. et al. European Consensus on the Diagnosis and Management of Iron Deficiency and Anaemia in Inflammatory Bowel Diseases. Journal of Crohn’s and Colitis, 2015; 211–222.
10. Forbes A, Escher J, Hebuterne X. et al. ESPEN guideline: Clinical nutrition in inflammatory bowel disease. Clinical Nutrition 2017; 36 321–347.
Cikk értékelése
| Eddig 1 felhasználó értékelte a cikket. |


Hozzászólások