1Szegedi Tudományegyetem, Szent-Györgyi Albert Orvostudományi Kar, Neurológiai Klinika, Szeged
Az epilepsziás rohamok differenciáldiagnosztikája
Az epilepsziás rohamok differenciáldiagnózisa nagy kihívás napjainkban is. Az epilepsziabetegek kb. egyharmada manapság is téves diagnózist kap, miközben a tünetek kiváltója a jóval gyakoribb akut szimptómás roham. Jelen összefoglalóban áttekintést adunk a felnőttkorban előforduló akut szimptómás epilepsziás rohamokról, az epilepsziabetegséget utánzó rohamjelenségekről, azok leggyakoribb okairól, és támpontot nyújtunk az epilepsziabetegségtől való elkülönítésükhöz.
Az epilepsziás roham a neurológiai funkciók átmeneti zavara, amelyet a neuronok rendellenes tüzelése okoz (Fisher, 2005). Életünk során 10%-nyi esélyünk van arra, hogy átéljünk egy epilepsziás rohamot. Azonban a populációnak csak 2-3%-áról derül ki, hogy epilepsziabetegségben szenved. Általában akkor gondolunk epilepsziás rohamra, ha valaki előttünk elesik, végtagjai rángani kezdenek és kontaktusképtelenné válik. Olyankor is felmerülhet bennünk a roham lehetősége, ha a páciens indokolatlan, sztereotíp mozdulatokat végez, amelyet tudatzavar is kísérhet.
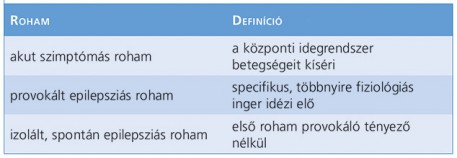
A magyar nyelvben meghonosodott kifejezések félrevezetőek lehetnek, ezért az első lépésben azt kell tisztáznunk, hogy az epilepsziás rohamot provokálta-e valamilyen tényező, vagy nem (1. táblázat). A központi idegrendszer betegségeit kísérő rohamokat az akut idegrendszeri károsodás következtében fellépő kiterjedt vagy szinkron agyi neuronaktivitás okozza, amelyet akut szimptómás rohamnak nevezünk, azaz tünete egy fennálló állapotnak. A provokált epilepsziás rohamok specifikus, többé-kevésbé fiziológiás ingerre következnek be. Lezajlott vagy izolált spontán epilepsziás roham az az első roham, amelynek hátterében nem találunk provokáló tényezőt. Az alkalmi roham, a konvulzió kifejezések mellőzését javasolja a magyar szakirodalom, mert nem tisztázzák a roham provokált vagy spontán voltát (Janszky és Fogarasi, 2017).
Az epilepsziabetegséget kísérő korlátozások (gépjárművezetés, bizonyos munkakörök, fegyverviselés stb.) és stigmák miatt fontos, hogy ezeket a fogalmakat elkülönítsük. Az epilepsziabetegség klasszikus definíciója szerint epilepsziabetegségről akkor beszélünk, ha legalább 24 óra különbséggel, 2 provokálatlan epilepsziás roham zajlik. Az International League Against Epilepsy (ILAE) 2014-ben (Fisher, 2014) kibővítette a korábbi definíciót azzal a megfontolással, hogy már egy provokáltalan epilepsziás roham után is felállítható legyen az epilepsziabetegség diagnózisa bizonyos körülmények között (2. táblázat). Így akkor is kimondható a betegség, ha csak egy provokáltalan epilepsziás rohama volt a betegnek, de a rohamismétlődés kockázata nagyobb, mint 60%, 10 éven belül (Kim, 2006), vagy epilepsziaszindróma diagnózisa állítható fel a rendelkezésre álló adatok alapján (pl. juvenilis mioklónusos epilepszia).
Míg az akut szimptómás roham prevalenciája 29-39/100 000 évente, az első nem provokált epilepsziás roham incidenciája 23-61/100 000, addig az epilepsziabetegség incidenciája világszerte 50,4/100 000. Egy 2011-es tanulmány szerint epilepsziás roham miatt a sürgősségi osztályon tett látogatások száma 1,6 milliót tett ki, amelyből 400 000 volt az új keletű, nem provokált epilepsziás roham.
Az új keletű epilepsziás rohamok anamnézisében fontos szempont a beteg megfelelő anamnézise, többek között a beteg kora, a családi anamnézisben előforduló epilepsziabetegség, a provokáló tényezők közül a jelentős alvásmegvonás és alkoholhasználat, a különböző gyógyszerek közelmúltbéli használata lehet segítségünkre. Érdemes rákérdezni az ún. prokonvulzív tulajdonságokkal rendelkező gyógyszerekre, úm. klozapin, buproprion, cefalosporinok, fluorokinolinok, baklofen és tramadol. Ezek azok a gyógyszerek, amelyek csökkentik a görcsküszöböt. A betegek gyógyszerlistáját ilyen szempontok alapján is érdemes átnézni. Gyakori provokáló tényezők az anyagcsere-rendellenességek, a szervkárosodás okozta állapotok (pl. veseelégtelenség kapcsán az urémia), illetve a mérgezések. Az akut szimptómás rohamok hátterének tisztázása során hasznos lehet a korábbi betegségek és műtétek áttekintése, a páciens perinatális anamnézise (születéskori szövődmények, koraszülöttség), korábbi KIR-gyulladások, koponyatraumák (főleg, ha eszméletvesztéssel társultak), korábbi idegrendszeri betegség vagy korábbi idegsebészeti beavatkozás. Nemcsak a beteg beszámolója, de ha rendelkezésre áll, heteroanamnézis is szükséges a pontosabb diagnózis felállításához. A beteg maga be tud számolni a prodromáról, ha van ilyen jelenség, de egy jó szemtanú tud csak támpontot adni a rohamot közvetlenül megelőző, a roham alatti és az azt követő eseményekről.
Amennyiben sem a betegtől, sem a környezettől nincs megfelelő információ, keressünk indirekt jeleket, amelyek elesésre utalnak, pl. sérülések, hematómák. A hátfájdalom jelezhet csigolya-összeroppanást, amely a megfeszülés vagy elesés kapcsán alakult ki. A páciensek 22%-ában a nyelv oldalsó részének harapási sérülése megtalálható, míg pszichogén nem epilepsziás rohamnál nem szokott előfordulni, így differenciáldiagnosztikai jelként is értékelhető (Brigo, 2012). Ugyanakkor a vizeletinkontinencia nem bizonyult segítségnek az epilepsziás roham, a syncope vagy a pszichogén nem epilepsziás roham elkülönítésében (Brigo, 2012).
A fokális neurológiai jelek és a neurokután eltérések epilepsziabetegség irányába mutatnak, amelyek gyakran kapcsolódnak pl. sclerosis tuberosához vagy Sturge–Weber-szindrómához.
A következő eldöntendő kérdés, hogy a paroxizmális jelenséget okozhatja-e egy, az epilepsziás rohamot utánzó állapot. Differenciáldiagnosztikai szempontból szóba jöhet syncope, tranziens iszkémiás attak, migrén, pszichogén nem epilepsziás roham, pánikbetegség, mozgászavar, alvászavar stb.
Az akut szimptómás epilepsziás és provokált rohamok okai
Akut szimptómás epilepsziás rohamoknak nevezzük azokat az epilepsziás rohamokat, amelyek a központi idegrendszert érintő behatástól számított hét napon belül jelentkeznek, pl. stroke-ot, traumás agyi károsodást vagy központi idegrendszeri infekciót követően (Beghi, 2010). Hét napon túl jelentkezhet a roham központi idegrendszeri gyulladásoknál vagy olyan szubdurális hematómánál, ahol nem ismert a koponyatrauma ideje. Sclerosis multiplexben első tünetként vagy a relapszus alatti hét napon belül jelentkezhet akut szimptómás roham, hasonlóan más akutan fellángoló autoimmun betegséghez. Kongenitális toxoplazmózisra és Creutzfeld–Jakob-betegségre a késői szimptómás rohamok, míg neurodegeneratív betegségekre a progresszív szimptómás rohamok jellemzőek.
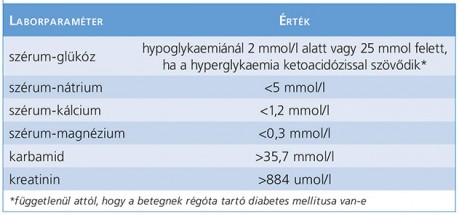
Minél gyorsabban alakul ki egy metabolikus zavar, annál nagyobb az esélye, hogy akut rohammal társul. Ezért fontos a rohamtól számított 24 órán belüli vérvétel a laboratóriumi vizsgálathoz, hogy ezeket az eltéréseket kimutathassuk. A különböző, potenciálisan rohamprovokáló anyagcsereértékeket a 3. táblázat tartalmazza. (3. táblázat)
Az alkoholintoxikáció és -megvonás is okozhat akut szimptómás rohamot. Ugyanígy a barbiturát- és a benzodiazepin-megvonás is. Bizonyos illegális drogok fogyasztásához is gyakran társulnak provokált rohamok, pl. kokain- és crackfogyasztáshoz, míg a heroin és a marihuána fogyasztásánál kevésbé jellemzőek.
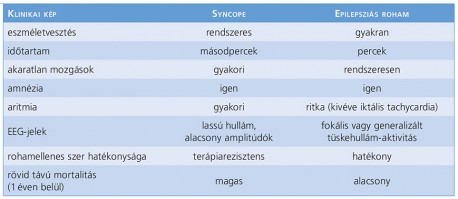
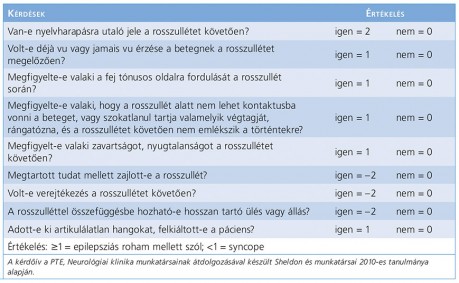
Felnőttkorban az alkoholmegvonás okozta provokált rosszullét után a syncope az egyik leggyakoribb, átmeneti tudatzavarral járó állapot. A syncope átmeneti, spontán múló tudatvesztés, amely relatív gyorsan következik be, és általában eleséshez vezet. A teljes visszarendeződés is külső hatás nélkül, magától és gyorsan történik. Az oka a tranziens globális agyi hipoperfúzió. A kettő elkülönítése azért is fontos, mert ha a beteget tévesen epilepsziabetegnek gondolják, a syncope hátterében álló okra nem derül fény, így azt nem kezelik, sőt bizonyos antiepileptikumok a nátriumcsatorna gátlása révén bradycardiát okozva a mortalitás kockázatát fokozzák, nem is említve az epilepsziadiagnózissal járó pszichoszociális kihatásokat (4. táblázat). Az epilepsziabetegek 20-35%-ánál a terápiarezisztencia okainak felkutatásakor derül ki, hogy a panaszok hátterében syncope áll. A nagyon fiatal betegeknél a vazovagális syncope vagy a hosszú QT-szindróma merül fel elsősorban etiológiaként, az idősebbekben sinuscsomó-betegséget vagy AV-blokkot, a legidősebb korosztályban pedig a sinuscarotis-betegséget érdemes kizárni (Bergfeldt, 2003). Vazovagális syncopét idézhet elő a vér látványa, a sérülés vagy az ortosztatikus stressz, az ortosztatikus hipotenzió és a szívritmuszavarok. A syncope is gyakran jelentkezik myoclonusokkal, amely gyakran téves következtetésekhez vezet. A syncope- és az epilepsziabetegek rohameltéréseinek megkülönböztetését segíti a 4. táblázat, míg az 5. táblázatban szereplő kérdőív az anamnézisfelvétel során segíti az egészségügyi dolgozót a megfelelő diagnózisban. A kérdőív specificitása és szenzitivitása is 94% a különböző rohamok elkülönítésében (Sheldon, 2013). (5. táblázat)
A fejtörést okozó másik differenciáldiagnosztikai probléma a pszichogén nem epilepsziás roham, amelyhez kellő gyakorlattal rendelkező neurológus, normál EEG-vizsgálati eredmény és kétes esetekben normál video-EEG-vizsgálati eredmény szükséges, amely utóbbi csak centrumokban érhető el. Az anamnesztikus adatokon túl az egyre szélesebb körben elterjedt lingvisztikai analízis, illetve strukturált kérdőívek segítenek elkülöníteni a pszichogén rohamokat a valódi provokálatlan epilepsziás rohamoktól (Beghi, 2020).
A kivizsgálás menete
Ha a beteg élete első rohamával jelentkezik, azt a sürgősségi betegellátó osztályon (SBO) javasolt mihamarabb kivizsgálni. Legjobb, ha az első 24 órában történik a laborvizsgálat. Az SBO-ra érkező betegeknél általában EKG is készül. Ezeknél a betegeknél feltétlenül indokolt az agyi képalkotó vizsgálat. CT-vel az új keletű rohamok 10%-ában, MRI-vel kb. 30%-ában találtak strukturális eltérést (Gavvala, 2016). Mivel az SBO-n a koponya- CT-hez gyakran könnyebb a hozzáférés, ez a vizsgálat történik meg először. A CT gyakran nem érzékeli a low-grade gliómák, arteriovenózus malformációk, hippokampális sclerosis vagy kérgi rendellenességek jelenlétét. Ha a betegnél az SBO-s kivizsgálás végén normális fizikális vizsgálattal és eltérés nélküli koponya-CT-vel és/vagy sürgősségi MRI-vel találkozunk, amennyiben továbbra is fennáll a strukturális károsodás gyanúja, további speciális, ún. epilepsziaprotokoll szerinti koponya-MRI-re van szükség.
Azoknál a pácienseknél, akiknél a rohamot követő 30-60 perc elteltével nem tér vissza a normális neurológiai működés, tudatzavaruk van, fokális neurológiai jeleket mutatnak, javasolt az osztályos felvétel és EEG-vizsgálat. Az új keletű epilepsziás rohamok miatt észlelt betegek körében az első EEG-n 29%-ban találtak eltéréseket, amely találati arány nő, ha az EEG-felvétel a rohamot követő 24-48 órában készült el. A koponya-MRI és az EEG jelentőségét mutatja, hogy egy tanulmány alkoholmegvonásosnak ítélt rohamok kapcsán 30%-ában talált epileptogén strukturális eltérést, amely korábbi fejsérüléshez volt köthető.
A rohamok ismétlődésének kockázata kb. 35% felnőtteknél az új keletű roham idejétől számított 5 éven belül. Ha a betegnek már két rohama volt, akkor ez a rizikó 75%-ra nő 5 éven belül. Azoknál a pácienseknél, akiknek a neurológiai státuszában eltérés van, az agyi képalkotó vizsgálat strukturális károsodást vagy az EEG-vizsgálat epileptiform eltérést mutat, éjszakai rohamok jelentkeznek, vagy korábbi koponyatraumához kapcsolódó rohamai voltak, magas a rohamok visszatérésének kockázata, és terápiát javasolt kezdeni. Amennyiben epilepsziabetegségre derül fény, vagy a rohamok eredetére nem derül fény, a beteget epileptológiai gondozásra érdemes utalni (Gavvala, 2016).
Terápia
Terápiaválasztásakor érdemes tisztában lenni a rohamismétlődés kockázatával, a roham típusával és etiológiájával, a rohamellenes terápia jellemzőivel és annak tervezett tartamával. A gyógyszeres terápia részletezése meghaladja a jelen összefoglaló kereteit.
Az akut szimptómás rohamok kapcsán (pl. koponyasérüléseknél preventíven is) indítható rohamellenes terápia, itt értelemszerűen elsősorban az iv. adható készítmények (valproát, levetiracetam, brivaracetam, sz. e. fenitoin) jönnek szóba, és az akut szakaszban javasolt az adásuk néhány hétig.
A terápiaválasztás szempontjait a beteg kora, neme, társbetegségei, a szedett gyógyszerekkel várható kölcsönhatása, és olykor a beteg anyagi helyzete is befolyásolja. Törekedni érdemes a személyre szabott terápiára.
A betegek felvilágosításakor kiemelten fontos, hogy a beteg megértse: mi a különbség az új keletű szimptómás roham és az új keletű epilepsziás roham között, legyen fogalma az ismétlődés kockázatáról, főleg ha ismert az etiológia. A beteg tájékoztatása során javasolt kitérni a görcsküszöböt csökkentő tényezőkre, mint pl. az alvásmegvonás, az alkohol- és droghasználat, a villogó fény vagy a stressz. A pácienseket arról is tájékoztatjuk, hogy a magasban és a mozgó gépek mellett történő munkavégzés nem javasolt, továbbá 15-19-szer nagyobb a rizikója a halálos kimenetelű fulladásos baleseteknek, összevetve az átlagpopulációval. Ezért a magas rizikójú tevékenységek, mint pl. a búvárkodás, hegymászás, felügyelet nélküli úszás vagy kádfürdőzés kerülése javasolt, helyette inkább a tusolást érdemes előnyben részesíteni. Külön megbeszélést igényel az úrvezetői és hivatásos gépkocsivezetői engedély, amelyet az aktuális törvényi rendelkezések szabályoznak.
Az epilepsziabetegség diagnózisának felállítása orvosi, szociális és érzelmi következményekkel is jár, a beteg követése epileptológiai gondozás keretében történik (Gavvala, 2016).
Összefoglalás
Elmondható, hogy az új keletű görcsrohamok differenciáldiagnosztikája kihívást jelent az orvos számára. Önmagában nem elég a roham látványa vagy a rohamleírás ismerete, ha mégolyan pontos is. Szükséges ismerni a beteg kórtörténetét, laboreredményeit, EKG-görbéjét, és elvégezni a képalkotó és/vagy EEG-vizsgálatot, szükség esetén a kardiológiai vizsgálatot strukturális szívrendellenesség, valamint ritmuszavar kizárására.
2. Beghi M, Cornaggia I, Diotti S, et al. The semantics of epileptic and psychogenic nonepileptic seizures and their differential diagnosis. Seizure: European Journal of Epilepsy 2021; (91): 141–145.
3. Bergfeldt L. Differential diagnosis of cardiogenic syncope and seizure disorders. Heart 2003; 89: 353–358.
4. Brigo F, Nardone R, Ausserer H, et al. The diagnostic value of urinary incontinence in the differential diagnosis of seizures. Seizure 2013; (22): 85–90.
5. Brigo F, Storti M, Lochner P, et al. Tongue biting in epileptic seizures and psychogenic events. Epilepsy Behav. 2012; 25(2): 251–255.
6. Fisher RS, Acevedo C, Arzimanoglou A, et al. ILAE official report: a practical clinical definition of epilepsy. Epilepsia 2014; 55(4): 475–82.
7. Fisher RS, van Emde Boas W, Blume W, et al. Epileptic seizures and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE). Epilepsia 2005; 46(4): 470–2.
8. Gavvala JR, Schuele SU. New-Onset Seizure in Adults and Adolescents A Review. JAMA 2016; 316(24): 2657–2668.
9. Janszky J, Fogarasi A. (eds.). Klinikai epileptológia. I. Az epilepsziáról és epilepsziás rohamokról általában. Budapest: Medicina K.; 2017. pp. 23–52.
10. Kim LG, Johnson TL, Marson AG, et al. Prediction of risk of seizure recurrence after a single seizure and early epilepsy: further results from the MESS trial. Lancet Neurol 2006; 5(4): 317–22.
11. Sheldon R, Rose S, Ritchie D, et al. Historical criteria that distinguish syncope from seizures. J Am Coll Cardiol. 2002; 40: 142–8.
12. Sheldon R. How to Differentiate Syncope from Seizure. Cardiol Clin. 2015; (33): 377–385.
13. Wyman AJ, Mayes BN, Hernandez-Nino J, et al. The First-Time Seizure Emergency Department Electroencephalogram Study. Ann Emerg Med. 2016; 0(0): 622–628.
Cikk értékelése
| Eddig 1 felhasználó értékelte a cikket. |



Hozzászólások